Resolução 483 simplifica importação de insumos para intubação de pacientes com COVID
Informativos . 23/03/21
Foi publicado em Diário Oficial da União de 19/03/2021 a Resolução Nº 483 de 19/03/2021 que dispõe, de forma extraordinária e temporária, sobre os requisitos para a importação de dispositivos médicos novos e medicamentos identificados como prioritários para uso em serviços de saúde, em virtude da emergência de saúde pública internacional relacionada ao SARS-CoV-2.
Os medicamentos e dispositivos médicos listados abaixo, estão mencionados no Anexo I desta Resolução, e poderão ser importados em caráter excepcional e temporário por órgãos e entidades públicas e privadas, incluindo os estabelecimentos e serviços de saúde sendo dispensados de regularização sanitária pela Anvisa. São eles:
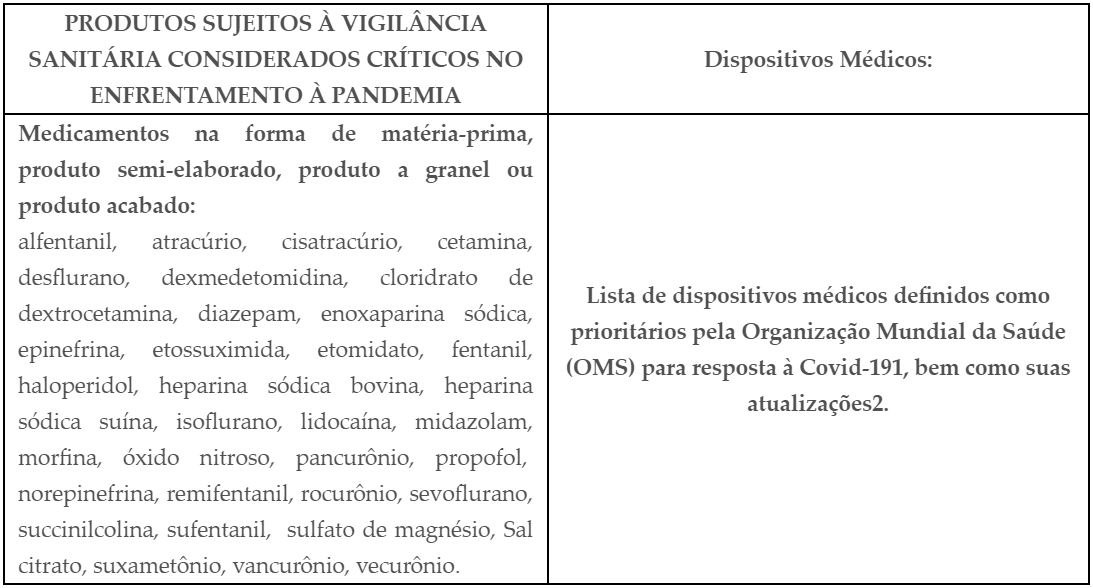
A dispensa de regularização dos produtos objeto desta Resolução não exime o importador
de cumprir as demais exigências aplicáveis ao controle sanitário de medicamentos ou dispositivos médicos e normas técnicas que lhes são aplicáveis e nem de realizar monitoramento pós-mercado e cumprir regulamentação aplicável ao pós-mercado.
O importador é responsável por garantir a qualidade, a segurança e a eficácia dos produtos importados em conformidade com esta Resolução.
- As empresas devem garantir a rastreabilidade dos produtos importados e permitir a identificação dos responsáveis pela distribuição.
- Os medicamentos e dispositivos médicos poderão ser importados com embalagens, rótulos e bulas nos padrões e idiomas estabelecidos pela autoridade sanitária estrangeira responsável pela aprovação da sua regularização.
Para realizar a importação dos medicamentos e dispositivos médicos supracitados, é necessário que os seguintes requisitos sejam cumpridos:
- I – Peticionamento eletrônico de importação, nos termos da Resolução de Diretoria Colegiada – RDC nº 81, de 5 de novembro de 2008;
- II – A descrição da mercadoria na licença de importação deve conter a inscrição “AUTORIZADA CONFORME A RDC nº XXX, DE 2021;
- III – Certificado de liberação do lote, incluindo o laudo analítico de controle de qualidade do produto acabado e, quando existir, do diluente, emitido pelo fabricante;
- IV – Conhecimento de carga embarcada;
- V – Licenciamento de importação (LI) registrado no SISCOMEX;
- VI – Autorização de Funcionamento (AFE) do importador, quando couber;
- VII – No caso de medicamentos, comprovante de pré-qualificação pela OMS ou de regularização válido em país cuja autoridade regulatória competente seja membro do Conselho Internacional para Harmonização de Requisitos Técnicos de Produtos Farmacêuticos de Uso Humano (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use – ICH);
- VIII – No caso de dispositivos médicos, comprovante de pré-qualificação pela OMS ou de regularização válido em país cuja autoridade regulatória seja membro do International Medical Devices Regulators Forum – IMDRF;
- IX – Comprovante de cumprimento de boas práticas de fabricação, ou documento equivalente, do país;
- X- Declaração que ateste a adoção das estratégias de monitoramento e cumprimento das diretrizes de farmacovigilância ou tecnovigilância, conforme modelo constante no Anexo II desta Resolução;
- XI – Declaração atestando tratar-se de importação de medicamento ou dispositivo médico essencial para auxiliar no combate à Covid-19, regularizado em autoridade sanitária estrangeira e autorizado à distribuição em seu respectivo país, conforme modelo Anexo III a esta Resolução; e
- XII – Declaração da pessoa jurídica detentora da regularização do produto junto à Anvisa autorizando a importação por terceiros, nos termos da Resolução de Diretoria Colegiada – RDC nº 81, de 2008, quando se tratar de produtos regularizados no país.
Os requisitos estabelecidos nos incisos VII a IX estão dispensados de análise técnica, ficando restritos à verificação da declaração do inciso XI.
Fica dispensada a apresentação dos demais documentos previstos na Resolução de Diretoria Colegiada – RDC nº 81, de 2008, exceto para bens e produtos sujeitos ao controle especial de que trata a Portaria SVS/MS nº 344, de 12 de maio de 1998, e suas atualizações, em suas listas “A1”, “A2”, “A3”, “B1”, “B2”, “C3” e “D1”.
A análise e anuência do processo de importação dos produtos descritos no Anexo I desta Resolução ficará restrita à verificação da documentação estabelecida neste artigo, pela área responsável pela anuência do Licenciamento de Importação.
Para medicamentos contendo substâncias sujeitas a controle especial, sujeitos ao Procedimento 1 da Resolução de Diretoria Colegiada – RDC nº 81, de 2008:
- É necessária a apresentação de Autorização de Importação Específica emitida pela área competente na ANVISA, na forma prevista pela Resolução de Diretoria Colegiada – RDC nº 367, de 6 de abril de 2020.
- As Autorizações de Importação Especificas estão isentas da obtenção prévia de Cota de Importação, e de autorização prévia favorável de embarque, conforme previsto pela RDC nº 367, de 2020.
- No pedido de Autorização de Importação Específica, solicita-se que o importador apresente a previsão das importações subsequentes, de modo a permitir a antecipação da gestão das estimativas de consumo de substâncias entorpecentes e psicotrópicas junto à Junta Internacional de Fiscalização de Entorpecentes.
- O código de assunto a ser utilizado no peticionamento de Autorização de Importação Específica é o 7690 – PRODUTOS CONTROLADOS – Autorização de Importação Específica de Substância/Medicamento para órgãos de repressão a drogas, entidade importadora de controle de dopagem, laboratório de referência analítica, instituição de ensino ou pesquisa.
Para os casos excepcionais em que houver a necessidade de alteração do quantitativo ou de unidades de produto para valor inferior ao autorizado, o importador deve requerer, junto à Anvisa, a Autorização para Fim de Desembaraço Aduaneiro (ADA), conforme previsto pela Resolução de Diretoria Colegiada – RDC nº 367, de 2020
A critério da autoridade sanitária, devido à necessidade de apresentação de informação complementar, a saída do produto da área alfandegada poderá ocorrer por meio de sujeição a Termo de Guarda e Responsabilidade, por lote, registrada no campo referente ao texto da situação do licenciamento de importação:

- Na situação prevista acima, a utilização dos produtos apenas pode ocorrer após liberação do Termo de Guarda e Responsabilidade, e;
- O importador deve realizar o pedido de liberação do produto mediante a apresentação da petição de liberação de Termo de Guarda e Responsabilidade.
A importação de medicamentos e dispositivos médicos nos termos desta Resolução somente se efetivará mediante deferimento de Licenciamento de Importação junto ao SISCOMEX.
Caberá ao importador:
I – peticionar junto à Anvisa o processo de importação, em tempo hábil, com antecedência à chegada da carga ao Brasil;
II – responsabilizar-se pela procedência, qualidade, eficácia e segurança do medicamento ou dispositivo médico a ser importado;
III – assegurar e monitorar as condições da cadeia de transporte;
IV – assegurar que os produtos importados estejam com o prazo de validade vigente;
V – estabelecer mecanismos para garantir condições gerais e manutenção da qualidade dos medicamentos e dispositivos médicos importados e o seu adequado armazenamento;
VI – no caso de medicamentos e dispositivos médicos que requeiram armazenamento sob refrigeração, assegurar o monitoramento da temperatura de conservação e transporte, durante o trânsito internacional, desde o momento do embarque até a chegada ao local de armazenamento do importador e notificar à Anvisa, imediatamente, caso tenha ocorrido excursão de temperatura que possa comprometer a qualidade do produto;
VII – responsabilizar-se pela avaliação das excursões de temperatura que venham a ocorrer durante o transporte dos produtos importados;
VIII – prestar orientações aos serviços de saúde sobre uso e cuidados de conservação dos produtos importados;
IX – deixar público que o produto não foi avaliado pela Anvisa quanto aos critérios de qualidade, eficácia e segurança, e que o referido produto possui aprovação em agência reguladora sanitária estrangeira; e
X – fornecer cópia dos métodos analíticos utilizados pelo fabricante, em até 48 (quarenta e oito) horas, quando solicitado pela autoridade sanitária.
As responsabilidades do importador quanto às ações de vigilância pós-distribuição e pós-uso dos produtos importados (monitoramento), seguem descritas no Artigo 9º da presente Resolução.
Caberá à Anvisa:
I – monitorar o perfil de queixas técnicas e eventos adversos associados aos produtos importados nos termos desta Resolução; e
II – adotar as ações de controle, monitoramento e fiscalização sanitária pertinentes.
Caberá ao serviço de saúde em que o equipamento eletromédico seja instalado, a responsabilidade pela instalação, manutenção, rastreabilidade e monitoramento durante todo o período de vida útil do dispositivo, incluindo seu descarte.
A Anvisa poderá convocar empresas a fornecerem informações sobre produtos importados nos termos desta Resolução.
Caberá a Anvisa, a partir das informações provindas do controle e monitoramento dos produtos do Anexo I, exercer o direito de suspensão de importação, distribuição e uso desses medicamentos e dispositivos médicos, conforme estabelecido em Art. 14. A saber:
“Art. 14. Com base em informações provenientes do controle e do monitoramento dos produtos definidos por esta Resolução ou outras informações técnicas ou científicas que venham a ser de conhecimento desta Anvisa, a Agência poderá suspender a importação, distribuição e uso dos medicamentos e dispositivos médicos importados nos termos desta Resolução, além de adotar outras medidas que entender cabíveis conforme legislação vigente.”
Ficam ampliados em 1 (um) ano os prazos de validade dos registros e notificações de dispositivos médicos concedidos em conformidade com a Resolução de Diretoria Colegiada – RDC nº 349, de 19 de março de 2020.
Esta Resolução entra em vigor na data de sua publicação e tem validade de 60 (sessenta) dias, podendo ser renovada enquanto reconhecida pelo Ministério da Saúde a emergência de saúde pública relacionada ao SARS-CoV-2.