Diretrizes de Boas Práticas de Fabricação de Medicamentos
Informativos . 31/03/22
Foi publicado no Diário Oficial da União de 31 de março de 2022, pela ANVISA, a Resolução RDC nº 658, de 30 de março de 2022 e as Instruções Normativas IN127/2022 a 138/2022, contemplando as Diretrizes de Boas Práticas de Fabricação de Medicamentos complementares alinhadas ao esquema de Cooperação em Inspeção Farmacêutica (PIC/S).
As normas revogam a RDC 301/2019 e as INs complementares vigentes, conforme a tabela abaixo:
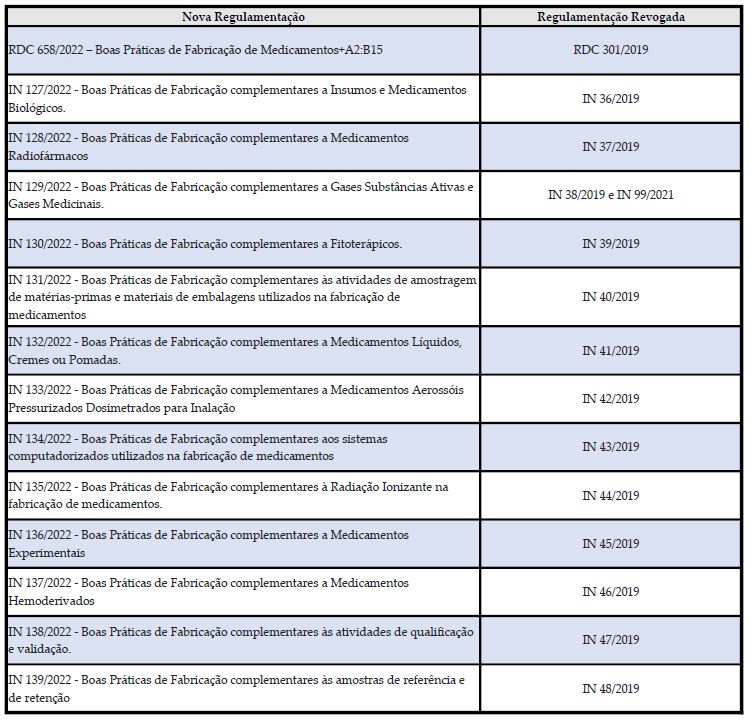
Lembramos que os documentos do Sistema de Gestão da Qualidade das empresas deverão ser revisados para atender / referenciar as novas normas que estarão vigentes a partir de 02 de maio de 2022.
Estas revisões são parte do processo predito pelo Decreto 10139/2019, que dispõe sobre a revisão e consolidação de atos normativos inferiores a decreto editados por órgãos e entidades da administração pública federal direta, autárquica e fundacional, sem contudo, impactando em alteração de mérito.
Clique nos links referentes a cada RDC ou IN para ter acesso às íntegras dos documentos: RDC 658/2022; IN 127/2022; IN 128/2022; IN 129/2022; IN 130/2022; IN 131/2022; IN 132/2022; IN 133/2022; IN 134/2022; IN 135/2022; IN 136/2022; IN 137/2022; IN 138/2022 e IN 139/2022.